
平衡常数是反映化学反应进行限度的重要参数。以热力学为基础,根据热力学关系而得到的平衡常数称为热力学平衡常数或标准平衡常数(standard equilibrium constant)。
(一)稀溶液中反应的标准平衡常数
对稀溶液中的可逆反应:
eE(aq)+fF(aq)■■■dD(aq)+hH(aq)在一定温度下达到化学平衡时,各物质的浓度不再随时间而变,这时的浓度称为平衡浓度(严格计算时应用活度)。E、F、D、H的相对平衡浓度之间存在如下定量关系:
式中,K■称为标准平衡常数或热力学平衡常数,其SI单位为1。ceq(D)、ceq(H)、ceq(E)、ceq(F)分别为平衡时D、H、E、F的物质的量浓度,c■表示标准物质的量浓度,c■=1mol·L—1。ceq(D)/c■、ceq(H)/c■、ceq(E)/c■、ceq(F)/c■分别表示D、H、E、F的相对平衡浓度。
上式表明,【在一定温度下,稀溶液中的可逆反应达到平衡时,反应物和生成物的相对平衡浓度以化学计量数为指数的幂的乘积是一个常数】。
因为c■=1mol·L—1,则K■的表达式也可简写为:
本书后面章节所涉及的有关标准平衡常数的计算,常用此简写式。
(二)气体混合物反应的标准平衡常数
对气体混合物中的可逆反应:
eE(g)+fF(g)■■■dD(g)+hH(g)
在一定温度下达到化学平衡时,E、F、D、H的分压都不再随时间而变,这时的分压称为平衡分压,E、F、D、H的平衡分压peq(E)、peq(F)、peq(D)、peq(H)之间存在如下定量关系:
式中,p■表示标准压力,p■=100kPa,peq(D)/p■、peq(H)/p■、peq(E)/p■、peq(F)/p■分别为D、H、E、F的相对平衡分压。
上式表明,【在一定温度下,气体混合物中的可逆反应达到平衡时,反应物和生成物的相对平衡分压以化学计量数为指数的幂的乘积是一个常数】。
(三)非均相反应的标准平衡常数
对非均相可逆反应:
eE(s)+fF(aq)■■■dD(l)+hH(g)在一定温度下达到平衡时,存在如下定量关系:
例如用盐酸溶解碳酸钙的离子反应:
CaCO3(s)+2H+(aq)=Ca2+(aq)+CO2(g)+H2O(l)该反应在一定温度下达到平衡时,其标准平衡常数的表达式为:

书写标准平衡常数表达式时应注意以下几点:
1.在标准平衡常数表达式中,各物种均以各自的标准态为参考态。所以,如果某物种是气体,则其分压要除以p■(100kPa);若是溶液中的某溶质,其浓度要除以c■(1mol·L—1);若是液体或固体,其参考态为相应的纯液体或纯固体。因此,表示液体和固体状态的相应物理量不出现在标准平衡常数的表达式中(称其活度为1)。
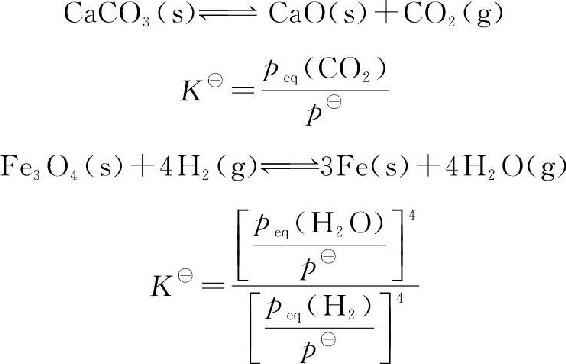
或简写为
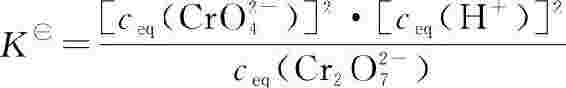
2.多重反应平衡体系中,任一种物质的平衡浓度或分压必须同时满足体系中多个平衡,因此,各标准平衡常数之间存在一定的关系。例如:
从反应式看(1)+(2)=(3),而且:

即:【将两个独立反应相加,所得总反应的标准平衡常数等于这两个相加反应的标准平衡常数之乘积。同理,将两个独立反应相减,所得反应的标准平衡常数等于这两个反应的标准平衡常数之商。这个规则叫多重平衡规则】。对一些难以直接测定或是不易从文献查得平衡常数的反应,可根据此规则间接计算它们的标准平衡常数。值得注意的是,使用多重平衡规则时,要求所有化学反应都是在同一温度下进行。
3.标准平衡常数的表达式和数值,与化学反应方程式的写法有关。化学反应方程式的写法不同,其标准平衡常数的表达式就不同。例如反应:
由于标准平衡常数是以生成物相对平衡浓度的乘积为分子,所以它能很好地表明化学反应进行的限度。在一定温度下,不同的化学反应各有其特定的标准平衡常数。标准平衡常数的数值越大,达到平衡时生成物的分压或浓度越大,而反应物的分压或浓度越小,反应正向进行的限度就越大;反之同理。
上一篇:节点电压方程和弥尔曼定理
下一篇:动态定价策略





.jpg)
.jpg)
