
【实验原理】 DNA 分子有线状的,也有一些非线状的,如复制叉和重组DNA结构。双向琼脂糖凝胶电泳技术就是被人们开发用于研究一些非线状DNA 分子的技术。双向琼脂糖凝胶电泳技术(2-D gel)实际上可分为两类:中性/中性双向凝胶电泳和中性/碱性双向凝胶电泳技术。它们的工作原理如下。
1.中性/中性双向凝胶电泳 非线状的DNA 分子在琼脂糖凝胶中的泳动行为和线状DNA 分子相比是不规则的,并且这种行为随着琼脂糖浓度或电压增加而加剧。而这正是中性/中性双向凝胶电泳的工作原理:在第一向中,样品在琼脂糖凝胶中以低琼脂糖浓度、低电压的条件进行电泳,DNA 分子主要根据其分子量大小被分离。在第二向中,则采用高浓度琼脂糖凝胶和较高电压条件,DNA 分子的分离主要根据其形状。
2.中性/碱性双向凝胶电泳 此方法适合用来分析DNA 复制中间体。这些中间体包括各种长度的新链部分。在第一向中与中性/中性双向凝胶电泳一样采用中性pH,将DNA分子按其分子量大小分开。在第二向中,采用碱性pH,使DNA 复制中间体中新链部分释放,并按其长度分离,如同在普通琼脂糖凝胶中一样。双向凝胶电泳在分析DNA 结构方面,最大的特点就是简便易行。它已成功地应用于酵母DNA 复制起点的定位、确定酵母复制叉阻抑点以及DNA 复制抑制剂机制等研究。本书所介绍的实验步骤适用于分析3~5kb的复制型的DNA 限制性片段。
【材料】
1.琼脂糖粉。
2.TBE 储存液(450mmol/L Tris-硼酸盐,10mmol/L EDTA),1L。
Tris 碱 54g
硼酸 27.5g
0.5mmol/L EDTA 20ml
溶于水中,室温保存。
3. 6×加样缓冲液:0.25% 溴酚蓝,0.25% 二甲苯菁,15% Ficoll溶于水中,室温保存。
4.碱性缓冲液(40mmol/L NaOH 和1mmol/L EDTA),1L。
5mol/L NaOH 8ml
0.5mol/L EDTA(pH 8.0) 2ml (需新鲜配制)
5.EB 储存液(10mg/ml):1g EB,100ml 去离子水,避光容器4℃保存。
【操作步骤】
1.中性/中性双向凝胶电泳
(1)第一向电泳(低琼脂糖浓度和低电压)

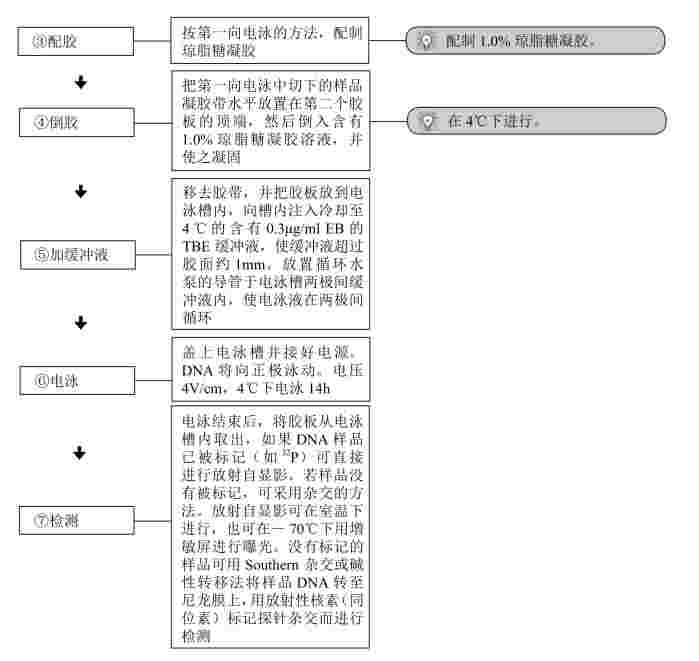
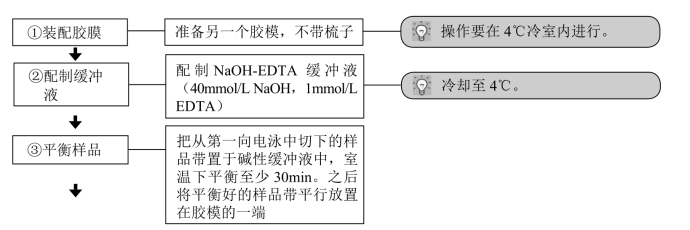
2.中性/碱双向电泳
(1)第一向电泳:中性/碱性双向电泳的第一向同中性/中性双向电泳的第一向电泳步骤几乎完全相同。
(2)第二向电泳(0.8%琼脂糖,NaOH-EDTA 缓冲液,电压1V/cm)。

【注意事项】
1.DNA 片段的大小对双向电泳条件的选择是一个关键因素,本实验所用例子为3~5kb。如果DNA 片段超过5kb,双向电泳的条件需要相应地改变。
2.加样量也是一个关键步骤,理想的加样量是300~1 000ng。
3.第一向电泳中,凝胶的长度应至少达到25cm,才能保证更好地分离。0.4%的琼脂糖凝胶比较脆,取梳子时要格外小心。
4.TBE 浓度最初采用90mmol/L Tris-硼酸盐和2mmol/L EDTA。但现在通常所用的浓度仅为其一半即可提供所需缓冲能力。
5.在整个中性/中性双向电泳过程中,要使用同一批TBE 储存液,以保证相同的离子强度和pH。
6.在双向电泳过程中,可在样品一端加合适的DNA 分子量标记物,帮助分析样品的大小和位置。在第一、第二向中,该标记物都起重要作用,尤其在第二向中作用更大。
(余海浪)





.jpg)
.jpg)
