
4.1 电化学加工基本原理和分类
4.1.1 电化学加工基本原理
(1)电化学加工的基本过程
将两片铜片作为电极,接上约12 V的直流电,并浸入CuCl2的水溶液中,形成如图4.1所示的电化学反应通道。金属导线和电解液中均有电流通过。在铜片(电极)和电解液的界面上,会有交换电子的反应,称为电化学反应。
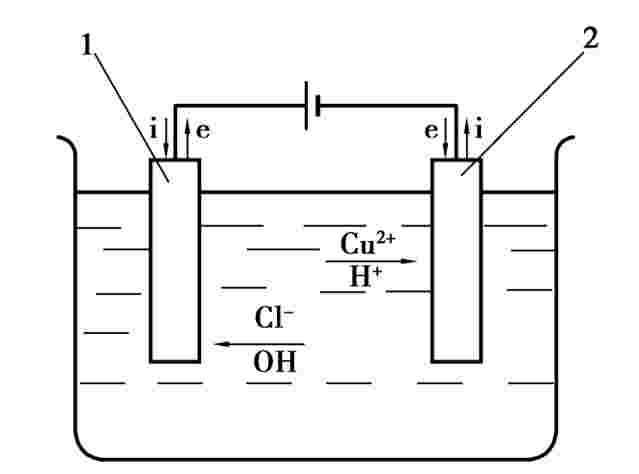
图4.1 电化学加工原理
1—阳极;2—阴极
如果接入直流电源,电解质中的离子将做定向运动,Cu2+离子向阴极(负极)移动,并在阴极得到电子,还原成铜原子沉积在阴极表面。相反,在阳极表面不断有铜原子失去电子,变成Cu2+离子而进入溶液(溶解)。电解质溶液中正负离子的定向移动称为电荷迁移。在阴阳两极产生得失电子的反应称为电化学反应。在图4.1中将会产生阳极溶解和阴极沉积,利用这种原理进行金属加工的方法称为电化学加工。其实,任何两种不同的金属放入任何导电的水溶液中,在电场的作用下都会有类似的情况发生。阳极表面失去电子(氧化反应)产生阳极溶解、蚀除,阴极得到电子(还原反应)的金属离子还原成位原子,沉积在阴极表面。
(2)法拉第定律
电解加工作为一种加工工艺方法,人们所关心的不仅是其加工原理,而且在实践上更关心其加工过程中工件尺寸、形状以及被加工表面质量的变化规律。而既可定性分析,又可定量计算,能够深刻揭示电解加工工艺规律的基本定律就是法拉第(Faraday)定律。
法拉第定律包括以下两项内容:
①在电极的两相界面处(如金属/溶液界面上)发生电化学反应的物质质量与通过其界面上的电量成正比,此称法拉第第一定律。
②在电极上溶解或析出1 mol当量任何物质所需的电量是一样的,与该物质的本性无关,此称法拉第第二定律。根据电极上溶解或析出1 mol当量物质在两相界面上电子得失量的理论计算,同时也被实验所证实,对任何物质这一特定的电量均为常数,称为法拉第常数,记为F,即
F≈96 500(A· s/mol,C/mol)≈1 608.3(A· min/mol)
对于电解加工,如果阳极只发生金属溶解而没有析出其他物质时,根据法拉第第一定律,金属溶解的理论质量为
![]()
式中 M──阳极溶解的金属质量,g;
k──单位电量溶解的元素质量,称为元素的质量电化学当量,g/(A· s)或g/(A·min);
Q──通过两相界面的电量,A· s或A· min;
I──电流强度,A;
t──电流通过的时间,s或min。对于原子价为n(更确切地讲,应该是参与电极反应的离子价,或在电极反应中得失电子数)、相对原子质量为A的元素,其1 mol质量为A/n(g);则根据式(4.1)可写为
![]()
可得
![]()
这是有关质量电化当量理论计算的重要表达式。
对于零件加工而言,人们更关心的是工件几何量的变化。由式(4.1)容易得到阳极溶解金属的体积为
![]()
式中 V──阳极溶解金属的体积,cm3;
ρ──金属的密度,g/cm3;
ω──单位电量溶解的元素体积,即元素的体积电化当量,cm3/(A·s)或cm3/(A·min)。
显而易见
![]()
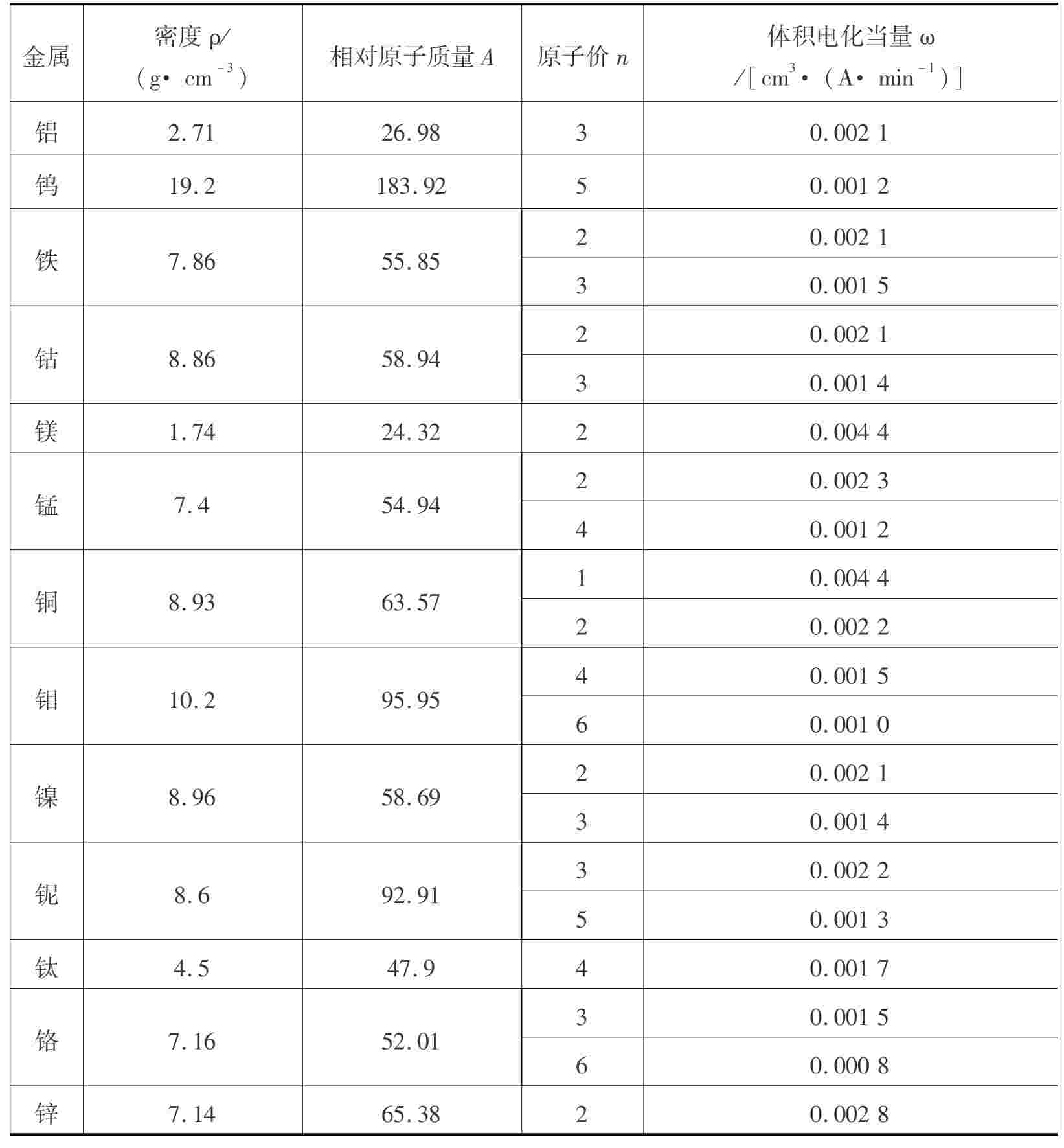
部分金属的体积电化当量ω值如表4.1所示。
表4.1 部分金属的体积电化当量
(3)电极电位
原子是由电子和原子核组成,金属原子也是由带负电的电子和带正电的原子核组成,最外层的电子受原子核的约束比较小,容易失去,使得原子变成了离子。金属的组成其实是金属离子叠加而成,外层的电子具有一定的自由性,不一定属于哪个离子,称为自由电子。当金属和金属原子组成的盐溶液(或其他溶液)接触时,弱极性分子水的负极端就吸附到金属正离子上,形成水化离子。当水的动能超过一定数值时,就克服金属对该离子的约束跑到溶液中去,这就等于把电子失去(留在金属里)。当然,溶液中的离子也有可能因动能不够而被金属俘获,相当于得到电子,变成原子。这是个动态的过程,在某个状态会达到平衡,即从金属上跑到溶液中的离子数量等于从溶液中跑回金属上的离子数量。当金属活泼性大时,金属本身因为留下的电子多就带上了负电,在金属附近的溶液里因带正电水化离子多而带正电,这样就形成了双电层(Etectric Double Layer,EDL)。双电层结构如图4.2所示。当金属的活泼性越强,这种趋势越强;反之,如果金属活泼性很差,甚至从金属上跑出来的离子比溶液里跑回到金属上的还多,则金属带正电,而溶液带负电。
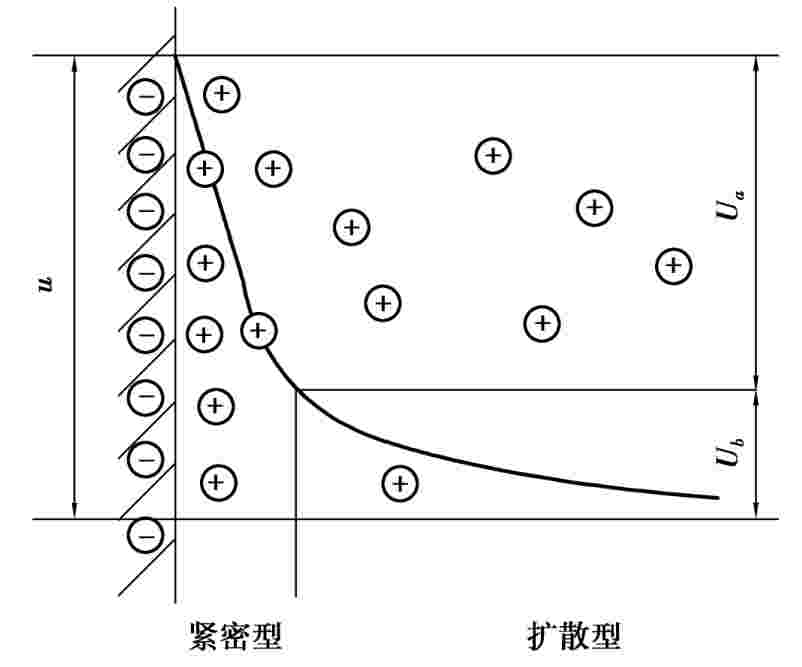
图4.2 双电层结构和电位分布
在给定溶液中建立起来的双电层,除了受静电作用外,由于分子、离子的热运动,使双电层的离子层获得了分散构造,双电层的电位分布如图4.2所示。只有界面上极薄的一层具有较大的电位差。
由于双电层的存在,在正负电层之间,也就是金属和溶液之间形成了电位差。金属及其盐溶液之间的电位差称为电极电位。由于是金属本身盐溶液中的溶解和沉积相平衡的电位差,故也称为平衡电极电位。
到目前为止一种金属与其盐溶液之间的电极电位还没有直接测量的办法,某金属与任一导电溶液之间的双电层的电位差也难以直接测量,但是盐桥法可测量出两种不同电极电位的差。生产实践中采用以一种电极作为标准和其他电极比较得出的相对值,称为标准电极电位。通常以标准氢电极电位作为基准,人为地将氢电极电位规定为零。如表4.2所示为常用离子在25℃时的标准电极电位,把金属放在此金属离子的有效质量浓度为1 g/L的溶液中,此电极的电位与标准氢电极的电位差,作为标准电极电位,用U°表示。用它可测算出不同材料的电极表面在不同的电解液中,哪些元素将首先发生电化学反应,即可用电位来测算不同元素之间产生电化学反应先后的可能性。一般电位最负的元素首先在阳极表面产生电化学反应,反之电位最正的元素首先在阴极表面产生电化学反应。表4.2反映了物质得失电子的能力,即氧化还原能力。
表4.2 常用离子在25℃时的标准电极电位

续表
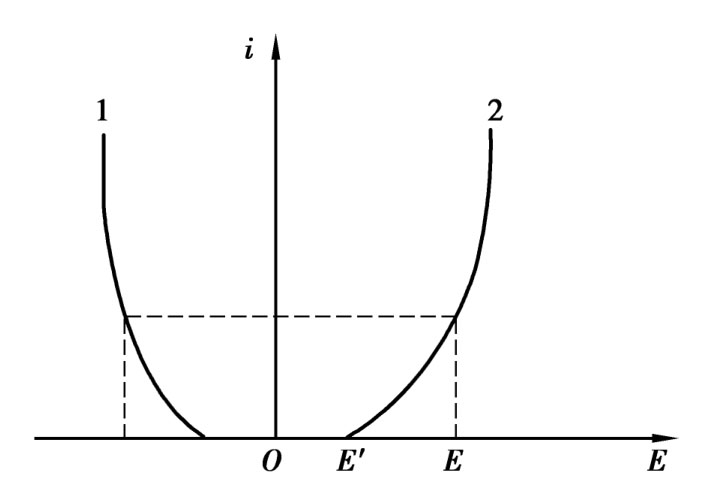
图4.3 电极极化曲线
1—阴极端;2—阳极端
(4)电极极化
前面讨论的是在没有电流通过电极时的平衡电极电位,电极界面上电荷交换处于平衡状态时的情况。当有电流通过时,电极的平衡状态被打破,使得阳极电位向正方向增大(代数值增大),阴极电位向负方向增大(代数值减小),这种现象称为电极极化。电极极化曲线如图4.3所示,极化后的电极电位(E)与平衡电极电位的差值称为超电位。随着电流密度的增加,超电位也会增加。
电解加工时,阳极和阴极都存在着离子扩散、迁移和电化学反应两个过程。在极化过程中,由于迁移、扩散缓慢引起的电极极化,称为浓差极化;而由于电化学反应缓慢引起的电极极化,称为电化学极化。
1)浓差极化
在极化过程中,金属不断溶解的条件之一是生成的金属离子需要越过双电层向外迁移和扩散,从而与溶液的离子反应,最后离开反应系统。然而扩散与迁移的速度是有一定的限制的,在外电场作用下,如果电化学反应过程进行很快,阳极表面液体层中的金属离子扩散、迁移缓慢,来不及扩散到溶液中去,使阳极表面形成金属离子堆积,引起电位增大,这就是浓差极化。
在阴极由于水中氢离子的移动速度很快,故一般氢的浓差极化是很小的。凡能加速电极表面离子的扩散和迁移速度的措施,都能减小浓差极化,如提高电解液流动速度、搅拌电解液、升高电解液温度等。
2)电化学极化
电化学极化也称活化极化,主要发生在阴极,从电源流入的电子来不及转移给电解液中的氢离子,因而在阴极上积累了过多的电子,使阴极电位向负移,从而形成电化学极化。
在阳极金属溶解的电化学极化一般很小,但是当阳极上产生析氧反应时,就会产生相当严重的电化学极化。
电解液的流速对电化学极化几乎没有影响,而仅仅取决于电化学反应,即与电极材料和电解液成分有关。此外,与电极表面状态、电解液温度、电流密度有关。电解液温度升高,反应速度加快,电化学极化减小;电流密度越高,电化学极化也越严重。
极化情况对电化学反应极为重要,它可帮助人们研究电极反应过程,有助于理解和掌握电化学加工机理。由上可知,在阳极电极电位低的物质容易失去电子,因此只要外加电压达到某物质的电极电位,该物质就开始失去电子。但是由于极化会使阳极的电位升高,在原来的电压下物质不会失去电子,极化明显影响阳极材料的溶解。
(5)活化和钝化
钝化极化是由于电化学反应过程中,会在阳极金属表面上形成一层致密而又非常薄的黏膜,这层黏膜由氧化物、氢氧化物或盐组成,也称为钝化膜,从而使金属表面失去了原有的活泼性,导致金属的溶解过程减慢,这就是通常所说的阳极钝化现象。
有时在某种极端的情况下,这层薄膜会完全阻止阳极金属的溶解。在电化学加工过程中,把去掉钝化膜这一过程称为活化。引起活化的因素很多,如把电解液加热、加入活性离子氯、通入还原性气体、采用机械的办法破坏钝化膜等。
4.1.2 电化学加工应用分类
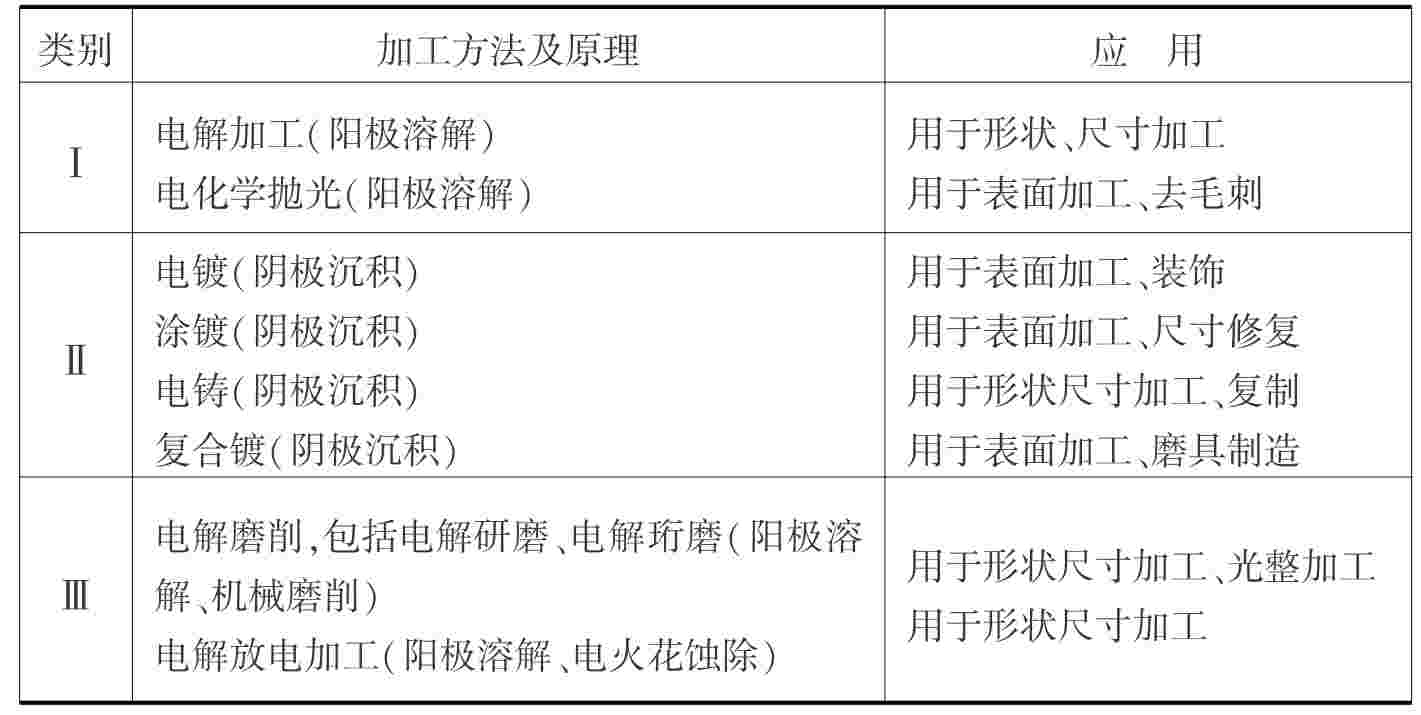
电化学加工按作用原理可分成3类。第Ⅰ类是利用电化学反应过程中的阳极溶解来进行加工,主要有电解加工和电化学抛光等;第Ⅱ类是用电化学反应过程中的阴极沉积来进行加工,主要有电镀、电铸等;第Ⅲ类是利用电化学加工与其他加工方法相结合的电化学复合加工工艺进行加工,目前主要有电解磨削、电解放电加工等。电化学加工的类别如表4.3所示。
表4.3 电化学加工应用分类





.jpg)
.jpg)
